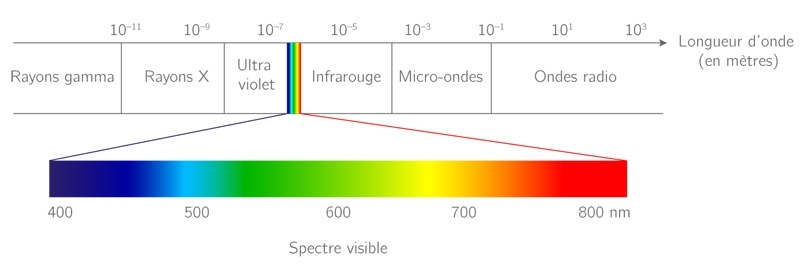
L'image ci-dessus représente le spectre total de la lumière. Vous pouvez constater que la lumière qui est visible par nos yeux n'est qu'une toute petite partie de la lumière.
Vous lisez cette note confortablement installé(e), du moins je vous le souhaite. À côté de vous peut-être un feutre rouge, un crayon papier jaune ou vert ou bien un calepin bleu. Pourquoi, me direz-vous, cette liste d'objets colorés ? Vous êtes-vous déjà demandé pourquoi nous voyons des couleurs et pas tout en blanc, puisque la lumière est blanche ? Qu'est-ce qui fait le rouge, le bleu ou bien une autre couleur ?
Depuis Maxwell on sait que la couleur correspond à la fréquence à laquelle la lumière est émise. Donc les substances n'émettent la lumière qu'à certaines fréquences. L'ensemble des fréquences qui caractérisent une substance s'appelle le "spectre" (non, ce n'est pas un fantôme !).
Un spectre est un ensemble de petites lignes colorées (voir l'image ci-dessous).

On connaissait les spectres de nombreuses substances, mais pourquoi telle substance avait-elle tel spectre et pas un autre ? Au début du 20ème siècle on ne le sait pas. Sans entrer dans les détails, sachez que c'est en rapport avec les atomes.
Je vous ai plusieurs fois parlé d'atome – dont l'existence a été démontrée par Einstein en 1905, et prouvée par Jean Perrin à partir de 1908 – et d'électron – découvert par J.J. Thomson en 1897 – mais qu'en est-il plus précisément ?
Un atome est une sorte de système solaire, c'est à dire un noyau (son soleil) et des électrons qui tournent autour (ses planètes).
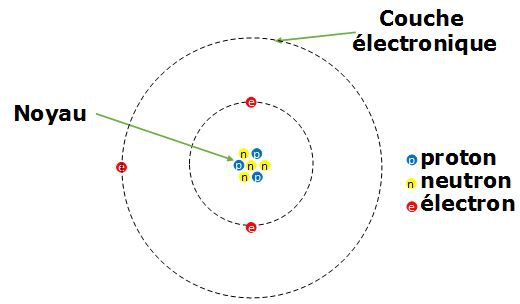
Représentation classique d'un atome
Donc un atome, comme les planètes, devrait obéir à la mécanique de Newton, c'est à dire qu'un électron devrait pouvoir tourner autour de son noyau à n'importe quelle vitesse et donc à n'importe quelle distance et de ce fait émettre une lumière blanche … ce qui n'est pas le cas. Pourquoi ? De plus, selon la physique classique, l'électron devrait finir par s'effondrer sur son noyau et donc la matière serait totalement instable, c'est à dire qu'elle se transformerait sans arrêt, ce qui n'est manifestement pas le cas puisque nous existons.
Eh bien ces questions, un jeune physicien danois, Niels Bohr (1885, Copenhague – 1962, Copenhague) qui s'intéresse aux atomes va y répondre.

En 1913, à 28 ans, Bohr émet l'idée originale que l'énergie des électrons ne peut prendre, elle aussi, comme la lumière, que certaines valeurs "quantifiées". Cela veut dire que les électrons, contrairement aux planètes autour de leur soleil, peuvent avoir seulement certaines orbites (on parle d'"orbitales" pour les électrons) mais pas toutes. De plus un électron peut "sauter" d'une orbitale inférieure à une supérieure en absorbant un "quantum" d'énergie, ou photon, égal à la différence d'énergie entre les deux niveaux. Et inversement, s'il passe d'un niveau supérieur à un niveau inférieur, c'est qu'il a cédé un quantum d'énergie, un photon.
Et cela s'avère exact et explique à la fois pourquoi les atomes n'émettent que certaines couleurs et pourquoi la matière reste stable. Cela lui vaudra le prix Nobel en 1922.
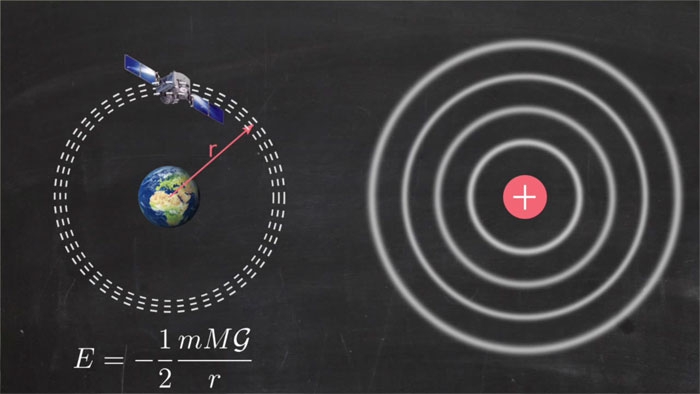
Contrairement aux planètes d'un système solaire (dessin de gauche), les atomes (dessin de droite) ne peuvent avoir que certaines orbites (des "orbitales")
On commence à se rendre compte à ce moment là que le fait qu'il y ait des "grains" (des quanta) de lumière et d'énergie est quelque chose de sûrement général pour toute la matière. La physique quantique prend son essor.
Par contre, encore une fois, cette nouvelle théorie pose de nouvelles questions. Ainsi va la science, à chaque réponse qu'elle apporte, de nouvelles questions se posent. Pourquoi les électrons ne peuvent-ils avoir que certaines orbitales et qu'est-ce qui fait qu'ils sautent de l'une à l'autre ?
Après avoir travaillé en Angleterre, entre autres avec J.J. Thomson (le découvreur de l'électron), Bohr est rentré à Copenhague où il a maintenant son propre laboratoire de recherches. Il y réunit les jeunes physiciens les plus prometteurs pour comprendre ces bizarreries.

Trois des cerveaux de l'"école de Copenhague" : Bohr, Heisenberg et Pauli
En 1926, à 25 ans, l'un d'entre eux, Werner Heisenberg (1901, Empire allemand – 1976, Munich) émet une idée complètement farfelue. Les électrons ne se manifestent que s'ils interagissent avec autre chose, lorsqu'ils se heurtent à quelque chose. Sinon ils ne sont … nulle part ! Il fournit des équations qui permettent de connaître la probabilité de la position des particules. C'est le deuxième gros morceau de la physique quantique : le caractère relationnel de toute chose. Et depuis, ses équations ne se sont jamais trompées !
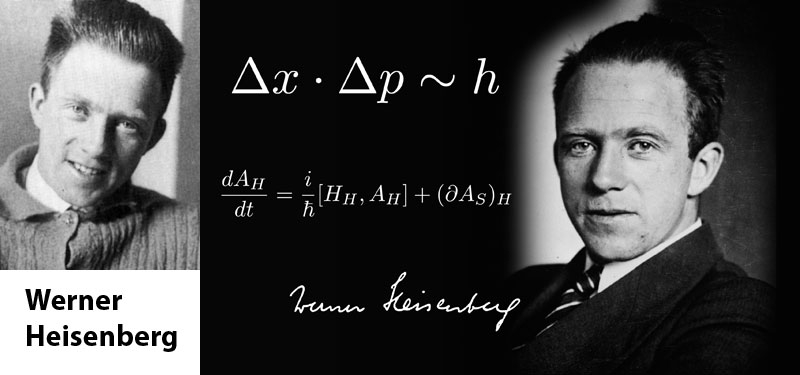
Suit en auditeur libre des cours de mathématiques supérieures afin de ne pas suivre les classes préparatoires ; Docteur en physique à 22 ans après seulement 3 ans d'études à l'Université !
Pour rappel, le premier morceau de la physique quantique est le fait que la matière est composée de "grains", au moins la lumière, ce qu'a démontré A. Einstein en 1905.
Je ne résiste pas au plaisir de vous raconter comment l'idée du caractère relationnel est venue à Heisenberg :
Il "se promène dans [un] parc. Il fait très sombre. Seuls quelques pâles lampadaires donnent un faible halo de lumière ici où là. Ces globes de lumière sont séparés par de larges espaces d'obscurité. Soudain, Heisenberg voit un homme qui passe. Plus exactement, il ne le voit pas passer : il le voit apparaître sous un lampadaire, puis disparaître dans le noir, réapparaître peu après sous un autre lampadaire, avant de disparaître de nouveau dans le noir. Et ainsi de suite, de halo en halo, jusqu'à se fondre dans la nuit. Heisenberg pense que, "évidemment", l'homme ne disparaît et ne réapparaît pas réellement, et qu'on peut reconstituer mentalement sa trajectoire entre deux lampadaires . Après tout, un homme est un objet grand, gros, lourd, et des objets grands, gros et lourds n'apparaissent et ne disparaissent pas comme cela …
Ah ! Ces objets, les grands, les gros et lourds, ne disparaissent et ne réapparaissent pas … mais qu'en est-il des électrons ? Et voilà l'éclair de génie de Heisenberg. Et si ce "évidemment" n'était plus valable pour les petits objets tels que les électrons ? Et si, effectivement, un électron pouvait disparaître et réapparaître ? Et si c'était cela, les mystérieux sauts quantiques d'une orbite à l'autre …" (Carlo Rovelli, "Par delà le visible", pages 108- 109).
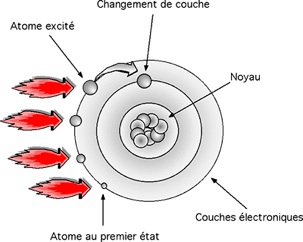
Un saut quantique : un électron "saute" d'une orbitale à une autre
En 1927, à 25 ans (encore!), un autre jeune physicien anglais, Paul Dirac (1902, Bristol, Angleterre, 1984, Floride, États-Unis), transforme les intuitions, les discussions, les calculs et les équations en une "architecture parfaite : aérienne, simple et très belle. Mais d'une abstraction stratosphérique.
«De tous les physiciens c'est Dirac qui a l'esprit le plus pur», dit de lui le vieux Bohr." (Carlo Rovelli, "Par delà le visible", page 112).
Même s'il est peu connu, il est considéré par beaucoup comme le plus grand physicien du 20ème siècle après Einstein.

La théorie qui découle de son formalisme mathématique, donne des informations sur ce qui se produira lors de la prochaine interaction, mais seulement de manière probabiliste. La mécanique quantique apporte l'indéterminisme au cœur de la matière. C'est la troisième pierre importante de la mécanique quantique : le hasard joue au niveau de l'atome. C'est un changement radical par rapport à la physique classique de Newton.
Si nous connaissons les données initiales, la mécanique newtonienne permet de prédire avec exactitude ce qui va se passer ensuite. Avec la mécanique quantique ce n'est plus possible. On ne peut calculer que la probabilité d'un fait.
C'est pourtant cette mécanique quantique qu'utilise ou à laquelle se réfère n'importe quel ingénieur, chimiste ou biologiste moléculaire actuel et qui a permis tant d'avancées techniques !
Si Paul Dirac est bien moins connu qu'Einstein, c'est dû, d'une part, au fait que sa science est abstraite, mais aussi, d'autre part, à son caractère très réservé et déconcertant. Il frôlait l'autisme d'Asperger, et peut-être, selon certains auteurs, en franchissait-il le seuil comme pourrait le montrer cette anecdote.
"Lors d'une de ses conférences, un collègue l'avait interrompu : «Je n'ai pas compris cette formule.» Dirac, après un bref silence, avait repris, imperturbable. L'animateur de la conférence l'avait interrompu en lui demandant de bien vouloir répondre à la question, et Dirac, sincèrement surpris : «Une question ? Quelle question ? Le collègue a formulé une affirmation, pas une question.» … l'homme qui voyait les secrets de la nature qui échappaient à tous les autres ne comprenait pas le langage implicite, il ne comprenait pas ses semblables …" (Carlo Rovelli, "Par delà le visible", page 111).
 Ce début de 20ème siècle a vu une multitude de jeunes gens particulièrement brillants qui en quelques années on fait faire un bond colossal à notre connaissance du monde.
Ce début de 20ème siècle a vu une multitude de jeunes gens particulièrement brillants qui en quelques années on fait faire un bond colossal à notre connaissance du monde.
Toutefois il est à remarquer que la théorie de la relativité (restreinte puis générale) n'est due qu'à un seul brillant esprit (Einstein), ce qui lui donne une telle cohérence. La mécanique quantique, elle, est due à de nombreux esprits. Il faut cependant noter que celle-ci remet tellement en question notre perception du monde, que même Einstein ne voulut pas l'accepter, et que durant quasiment toute sa vie, il batailla avec Bohr pour tenter de lui montrer que la mécanique quantique ne pouvait pas être une théorie expliquant le monde.
À propos du troisième principe, le principe d'indéterminisme, il aurait même écrit à Bohr, «Dieu ne joue pas aux dés.». Ce à quoi Bohr lui aurait répondu, «Qui êtes-vous pour dire à Dieu ce qu'il doit faire !»

Je ne vous ai parlé que de trois des plus grands cerveaux de cette époque merveilleuse pour la science, en particulier parce que c'étaient de jeunes hommes, mais je pourrai également citer Henri Poincaré, Wolfgang Pauli, Erwin Schrödinger, dont j'aurai l'occasion de reparler, de Georges Lemaître ou de Louis de Broglie tous cerveaux qui ont participé à cette formidable avancée de la science.

Le congrès de Solvay 1927 - ceux avec une étiquette jaune ont eu ou auront le Prix Nobel
Remarquez qu'il n'y a qu'une seule femme, Marie Curie, mais c'est aussi la seule à avoir reçu deux fois le prix Nobel
Participants au 5e Congrès Solvay tenu en octobre 1927 sur le thème « Électrons et photons » à l'Institut international de physique Solvay dans le parc Léopold à Bruxelles. (Dix-sept des vingt-neuf personnalités présentes sont lauréates d'un prix Nobel.)
Rangée à l'arrière : Auguste Piccard, Émile Henriot, Paul Ehrenfest, Édouard Herzen, Théophile de Donder, Erwin Schrödinger, Jules-Émile Verschaffelt, Wolfgang Pauli, Werner Heisenberg, Ralph H. Fowler, Léon Brillouin ;
Rangée du milieu : Peter Debye (en Chimie), Martin Knudsen, William Lawrence Bragg, Hendrik Anthony Kramers, Paul Dirac, Arthur Compton, Louis de Broglie, Max Born, Niels Bohr ;
Rangée à l'avant : Irving Langmuir (en Chimie), Max Planck, Marie Curie (2 fois, en Physique et en Chimie), Hendrik Antoon Lorentz, Albert Einstein, Paul Langevin, Charles-Eugène Guye, Charles Thomson Rees Wilson, Owen Willans Richardson.
Nous avons avancé un pied au bord du monde que nous allons maintenant explorer, celui de l'extrêmement petit, donc celui de la mécanique quantique, qui est à la base de absolument toute la matière, donc de nous, humains, et de l'Univers tout entier.
PS : vous avez remarqué qu'une bonne partie de cette note est inspirée et documentée grâce au livre de Carlo Rovelli, "Par delà le visible", physicien italien dont j'aurai l'occasion de vous reparler.
À très bientôt.
Commentaires
Bonsoir Dean,
c'est un magnifique article. J'ai eu beaucoup de plaisir de le lire.
Ce monde de génies avec leur intelligence supérieure est tellement fascinant!
Je commence à m'habituer à ce nouveau langage, je lis tes notes avec plus de fiscalité :)
Passe une bon weekend.
Je vais essayer de poster demain ma nouvelle note florale :)
Amitié