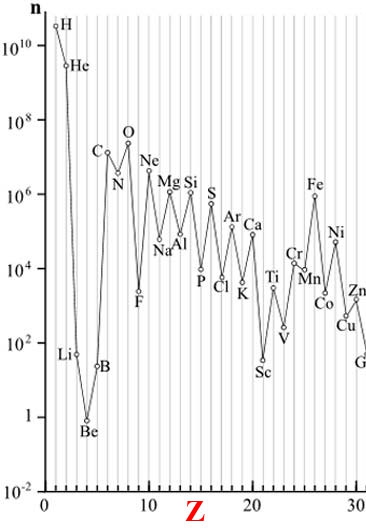
abondance des éléments
L'image ci-dessus représente l'abondance de quelques éléments présents dans l'Univers (les plus nombreux) et ici, plus précisément dans le système solaire. Vous pouvez constater que l'hydrogène (H) est nettement le plus abondant ainsi que l'hélium (He). Le lithium est une exception : il y en a peu. C, le carbone, N l'azote (N car en anglais l'azote s'appelle Nitrogen) et O l'oxygène sont également très nombreux. Un peu plus loin, le fer (Fe) montre également un pic. (le Z - en abscisse - représente le nombre atomique, c'est à dire le nombre de protons, ou le nombre d'électrons puisqu'il y a autant de protons qu'il y a d'électrons dans l'atome, et le n - en ordonnée - représente le nombre relatif des atomes les uns par rapport aux autres).
L'hydrogène et l'hélium composent respectivement environ 92 % et 7 % de toute la matière de l'Univers, le reste étant représentés par tous les autres atomes !
Notre corps est composé à 99 % de CHON : Carbone, Hydrogène, Oxygène, Azote.
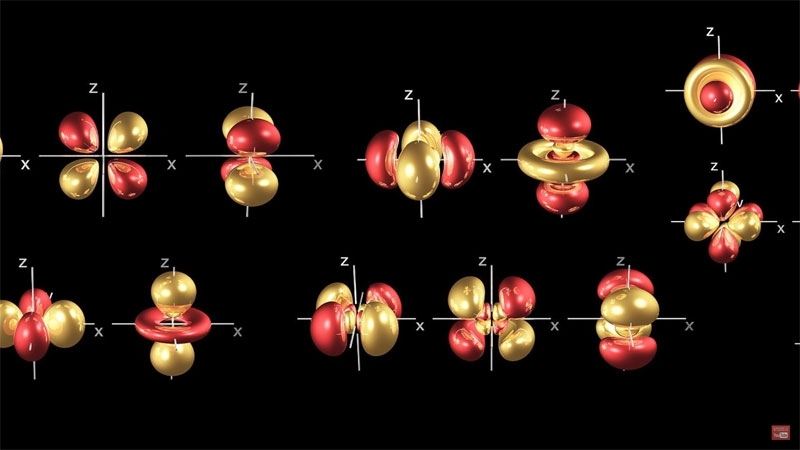
Revenons à nos particules et plus précisément aux électrons. Des électrons il y en a partout. La lumière aussi est partout. La lumière est "portée" par les photons. Il arrive parfois qu'un photon heurte un électron, et là il peut se passer une chose extraordinaire. Je vous ai dit dans la note précédente que les orbitales étaient à des distances précises les unes des autres. Donc pour sauter d'une orbitale à une autre il faut que l'électron acquière juste la quantité d'énergie nécessaire, pas plus, pas moins.
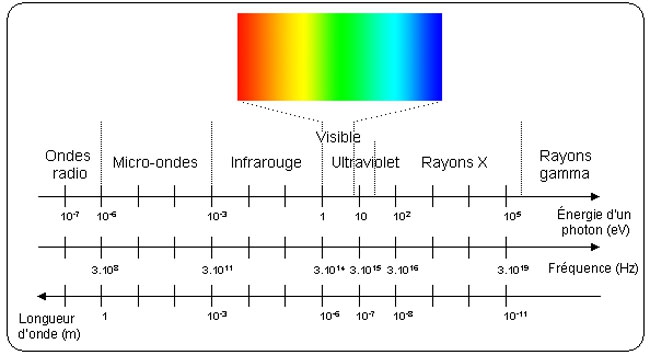
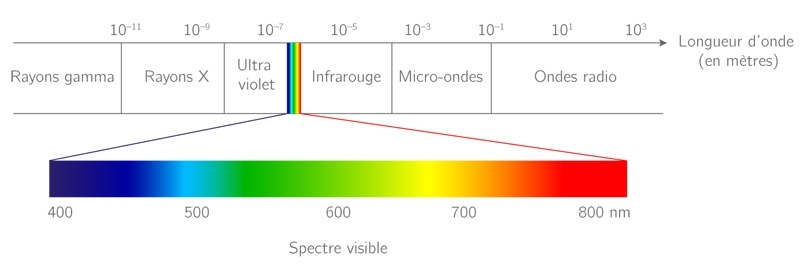
les niveaux d'énergie de la lumière