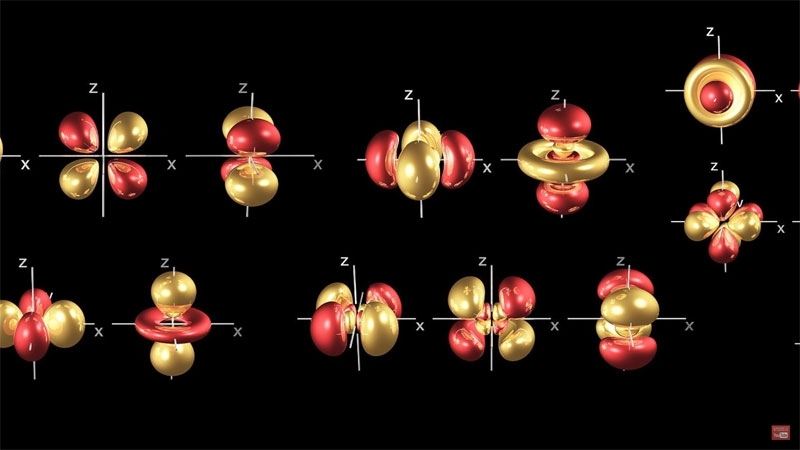
L'image ci-dessus représente différentes images d'un électron en trois dimensions.
Aujourd'hui nous allons explorer la matière et voir quelles sont ces particules-ondes (ces "ondicules") qui la composent et voir un peu plus comment elles se comportent.
La matière, toute la matière quelle qu'elle soit : roches, plantes, animaux dont nous-mêmes, est composée de ces seules particules-ondes. Seule leurs nombres, leurs liaisons et leurs agencements diffèrent.
Si nous prenons un minuscule morceau de matière, nous allons obtenir un atome. Atome vient d'un mot grec qui signifie "que l'on ne peut pas couper". Bien sûr les philosophes grecs de l'antiquité qui pensaient que la matière était constituée de minuscules parties que l'on ne pouvait pas diviser, les atomes, ne connaissaient pas l'atome de la même façon que nous mais imaginer cela était particulièrement remarquable.
Nous avons donc un atome mais nous savons depuis un peu plus d'un siècle, que l'atome n'est pas la partie la plus petite de la matière.
Un atome est composé d'un ou plusieurs électrons et d'un noyau. Étant donné le comportement de l'électron – qui est une onde-particule (et pas seulement l'électron, toutes les particules élémentaires) – seul une séquence filmée pourrait vous donner une idée de ce qu'est un atome. La moins mauvaise représentation par une image est figurée ci-dessous. L'image ci-dessous représente un atome d'hydrogène qui ne comporte qu'un seul électron autour de son noyau, dont on ne sait pas quelle est sa position.
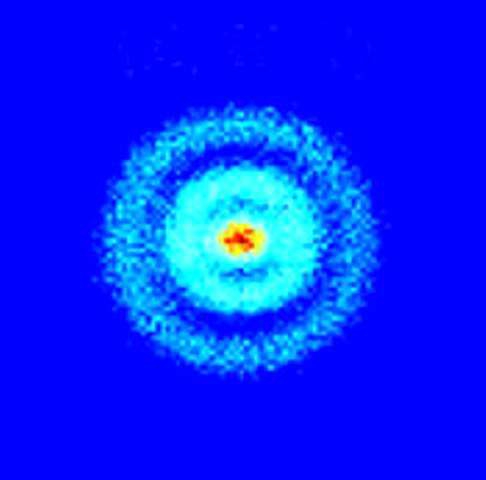
un nuage flou de l'électron tournant autour du noyau
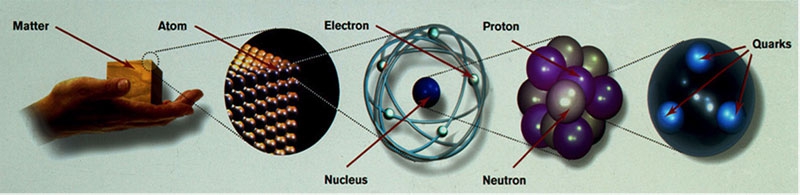
les constituants de la matière
Donc l'atome peut être divisé, ou plutôt il est constitué d'éléments encore plus petits. Les électrons qui naviguent autour d'un noyau, lui-même constitué de protons et de neutrons, eux-mêmes constitués de quarks.
Une chose remarquable, c'est que ces particules élémentaires – les plus petites particules connues actuellement – bien que extrêmement petites sont extrêmement éloignées les unes des autres !
Un atome d'hydrogène, avec un seul électron, mesure 10¯¹º mètre, soit 1 dix milliardième de mètre, ou 10 nanomètres, mais le noyau, lui, mesure 2,82*10¯¹⁵ mètre, soit 2,82 milliardième de milliardième de mètre, ou 2,82 femtomètre. Pour vous donner une idée de ces nombres que l'on n'arrive pas à se représenter, si le noyau mesurait 2,82 mètres, l'électron serait à 100 kilomètres ! Autant dire la très grande banlieue !
Je vous ai parlé de l'hydrogène parce que c'est le plus simple, le plus petit et le premier à avoir été créé. Au moment du Big Bang seul les atomes d'hydrogène et aussi un peu d'atomes d'hélium, ainsi qu'un tout petit peu d'atomes de lithium ont été créés. Les atomes d'hydrogène sont aussi les plus nombreux dans l'Univers. On en trouve partout. Par exemple dans le cœur des étoiles, où ils fusionnent pour fabriquer des atomes plus gros, à l'origine de la matière.
Regardons un atome d'un peu plus près. Il y a donc le noyau, et puis très loin de lui une sorte de vague qui tourbillonne autour, l'électron. Une représentation standard mais fausse ressemble à peu près à l'image ci-dessous.
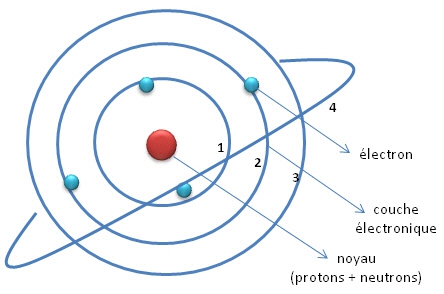
En quoi est-elle fausse ? D'abord parce que les électrons (les boules bleues) sont beaucoup, beaucoup trop près de leur noyau. Ensuite parce qu'un électron ne peut pas être représenté par une boule, ni son mouvement par un cercle ; en fait on ne peut pas savoir où il est, seulement avoir une probabilité qu'il est dans telle zone. En fait une image plus correcte ressemblerait à ceci.
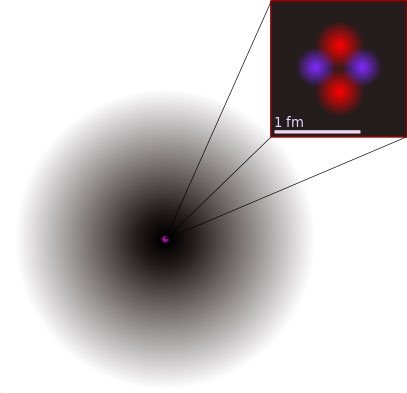
Le noyau minuscule vu la distance entre le "nuage" et les orbitales des électrons
(on parle d'orbitale pour les électrons au lieu d'orbite)
Alors pourquoi vous montré-je cette image fausse ? Pour introduire le fait que excepté l'hydrogène, les atomes possèdent plusieurs électrons qui tourbillonnent autour de leur noyau. Et là une particularité étonnante existe …
Comparons temporairement un système planétaire autour d'une étoile et un atome.

un système planétaire
Dans un système planétaire, les planètes peuvent être sur une orbite située à n'importe quelle distance de leur étoile (si elles ont ont la bonne vitesse de rotation autour de leur étoile). Les électrons aussi peuvent être sur plusieurs orbitales, mais pas n'importe lesquelles. Ils ne peuvent se trouver que sur certaines orbitales.
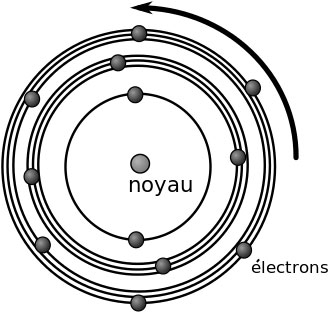
orbitales autorisées
Ceci est très important car sans cela les électrons s'effondreraient les uns après les autres sur leur noyau, disparaîtraient et la matière n'existerait pas ! Et donc nous ne serions pas là.
Curieux, vous me demandez alors pourquoi les électrons s'effondreraient alors que les planètes ne s'effondrent pas ? C'est simple. Les planètes n'étant pas chargées électriquement, leur vitesse, qui les maintient sur leur orbite, ne se modifie pas, et ainsi elles restent sur cette orbite. Par contre les électrons, eux, sont chargés électriquement. Ils sont même chargés négativement, tandis que le noyau, lui, est chargé positivement. De ce fait, s'ils pouvaient approcher suffisamment du noyau, ils réagiraient comme les aimants, ils seraient attirés par le noyau et disparaîtraient et nous ne serions pas là.
De plus, outre le fait qu'ils ne peuvent pas être sur n'importe quelle orbitale, celles-ci sont à des distances très précises les unes des autres, distances que les scientifiques ont calculé. Ils ne peuvent pas non plus se positionner n'importe comment sur les orbitales. Sur la première, celle qui est la plus proche du noyau, ils ne peuvent être que deux.
Là une autre règle s'impose à eux. Avant de s'installer sur une nouvelle orbitale, les électrons doivent impérativement remplir l'orbitale inférieure. C'est ainsi. Donc deux sur la première orbitale, puis huit sur la deuxième orbitale, puis dix-huit sur la troisième, et ainsi de suite. Cette particularité est la même pour tous les atomes de l'Univers.
Par contre une chose étonnante, un électron peut passer d'une orbitale à une autre. C'est ce qu'on appelle un saut quantique. Un électron excité – c'est à dire qui reçoit de l'énergie – peut passer d'une orbitale inférieure à une orbitale supérieure. Le processus inverse nécessite que l'électron perde de l'énergie.
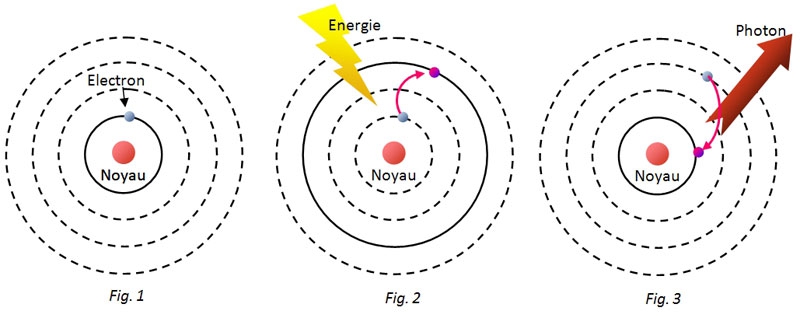
un saut quantique ; de l'énergie excite l'électron qui saute sur une orbitale supérieure (figure 2) avant de redescendre sur son orbitale d'origine en libérant un photon (figure 3)
L'hydrogène qui ne possède qu'un seul électron ne remplit pas entièrement sa première orbitale, ce qui a permis a un second électron de venir s'y accrocher pour former l'atome d'hélium. Le lithium comporte trois électrons, donc un – seul – sur la deuxième orbitale. Vous constatez que les trois premiers atomes de l'Univers, les seuls à avoir été créés lors du Big Bang, ne comportent qu'un seul, deux et trois électrons. Ce sont les atomes les plus simples. Tous les autres atomes ont été créés plus tard, dans les étoiles par la fusion de plusieurs atomes.
L'atome qui sature les deux premières orbitales est le néon. Il possède deux électrons sur la première orbitale puis huit sur la deuxième, soit dix électrons en tout. Pour celles et ceux qui ont des souvenirs de chimie, vous retrouvez le tableau de Mendéleïev, ou tableau périodique des éléments. Tous les électrons de l'Univers sont absolument identiques, donc ce qui différencie un atome d'un autre est son nombre d'électrons.
Je vous ai dit ci-dessus que les électrons sont chargés électriquement. Chaque électron a une charge électrique négative. Or, heureusement les atomes, tous les atomes, sont électriquement neutres, sinon nous serions attirés, aimantés par tout un tas d'objets ! Aussi pour que les atomes soient électriquement neutres, il est nécessaire qu'à chaque électron – chargé négativement – corresponde une charge positive. Cette charge se trouve dans le noyau. Je vous ai dit plus haut que le noyau est composé de proton(s) et de neutron(s). Comme vous le devinez le neutron est neutre électriquement, donc ce sont les protons qui équilibrent la charge électrique des électrons. A chaque électron correspond, dans le noyau, qui lui est unique, un proton chargé positivement. Ainsi un atome qui comporte 92 électrons – l'uranium– comporte 92 protons dans son noyau et des neutrons. (voir Note 1 en bas de page).
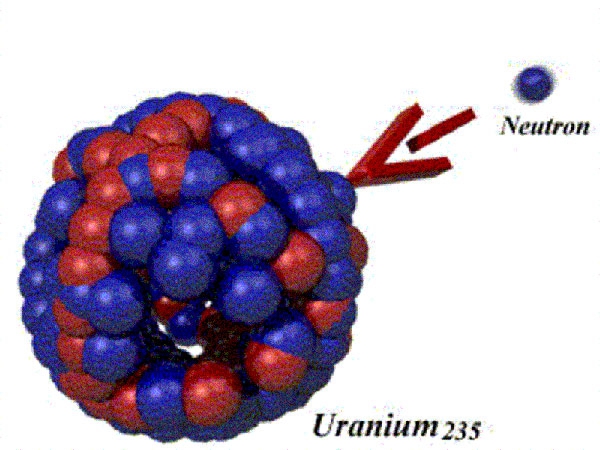
un atome d'uranium 235
Là je vais à nouveau citer Christophe Galfand car il est difficile de l'expliquer plus clairement : "Dans une orbitale remplie, il n'y a plus de place pour un nouvel arrivant. Si un électron supplémentaire (qu'il soit seul ou qu'il appartienne à un autre atome) voulait vraiment intégrer un tel atome déjà constitué, il devrait soit s'installer plus loin que les électrons autochtones [sur une autre orbitale], soit prendre la place d'un des habitants déjà en place, en le mettant dehors. …
Cette règle de non-cohabitation porte un nom : il s'agit du principe d'exclusion de Pauli. … Les conséquences de [ce] principe sont tellement profondes que le prix Nobel de physique fut décerné en 1945 [à son découvreur Wolfgang Pauli].
Le principe d'exclusion explique pourquoi les aimants collent aux portes des réfrigérateurs sans les traverser ou, peut-être plus important encore, pourquoi nous ne traversons pas le sol, les murs ou le plancher de nos maisons. Ce principe explique également pourquoi vous pouvez tenir [un] livre entre vos mains : les électrons contenus dans les atomes de sa couverture refusent catégoriquement de laisser leur place à ceux présents au bout de vos doigts. Vos électrons ne voulant pas non plus céder, le livre et vos doigts restent séparés". ("L'Univers à portée de main", édition "J'ai lu", pages 279-280).

un passe muraille
Par contre deux atomes peuvent partager un ou plusieurs électrons et lorsque deux ou plusieurs atomes se lient, ils forment une molécule. L'image ci-dessous vous montre un cas particulièrement bien connu : deux électrons d'hydrogène se lient à un électron d'oxygène pour former la molécule … H2O, l'eau ! Comptez bien : la première orbitale de l'oxygène possède bien deux électrons mais si un électron de chacun des deux atomes d'hydrogène ne s'était pas lié à l'oxygène, il n'y aurait que six électrons sur la deuxième orbitale et l'atome d'oxygène – tout seul – ne comporte effectivement que huit électrons, deux sur la première orbitale et six sur la seconde. Les atomes cherchent toujours à compléter leurs orbitales. Aussi afin de remplir complètement sa deuxième orbitale, l'atome d'oxygène a cherché à se lier avec deux autres électrons, qu'il a trouvé chez deux atomes d'hydrogène. De cela nous pouvons conclure que l'eau se forme (aussi) dans l'espace.
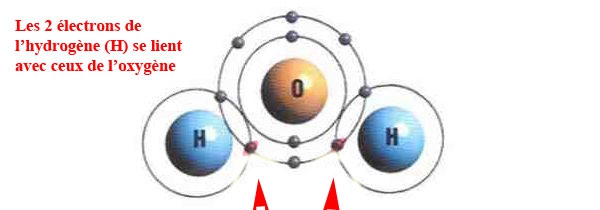
le partage d'électrons entre un atome d'oxygène et deux atomes d'hydrogène
La semaine prochaine nous verrons encore d'autres propriétés étonnantes de ces particules.
Note 1 : l'uranium comporte donc 92 électrons et 92 protons mais il comporte entre 125 et 150 neutrons. On appelle un atome qui comporte un nombre différent de protons et de neutrons un isotope. Ainsi l'uranium 235 comporte 92 protons et 143 neutrons (92 + 143 = 235) et l'uranium 238 comporte toujours 92 électrons et 92 protons mais 146 neutrons.
Note 2 :ces sujets étant particulièrement difficiles, n'hésitez pas à demander une précision si quelque chose ne vous paraît pas clair.
Sources :
L'image de l'électron en 3D : https://fineartamerica.com/featured/2-3d-electron-orbitals-dr-mark-j-winter.html
L'image des orbitales autorisées : Par Tankist-777 — Travail personnel, CC BY-SA 3.0 :
https://commons.wikimedia.org/w/index.php?curid=41501717
À bientôt.
Commentaires
Bonsoir Dean,
Oui, ce sujet est très difficile . Il semble que la règle de Pauli ne s'applique pas seulement aux électrons :)
Bonne continuation A bientot